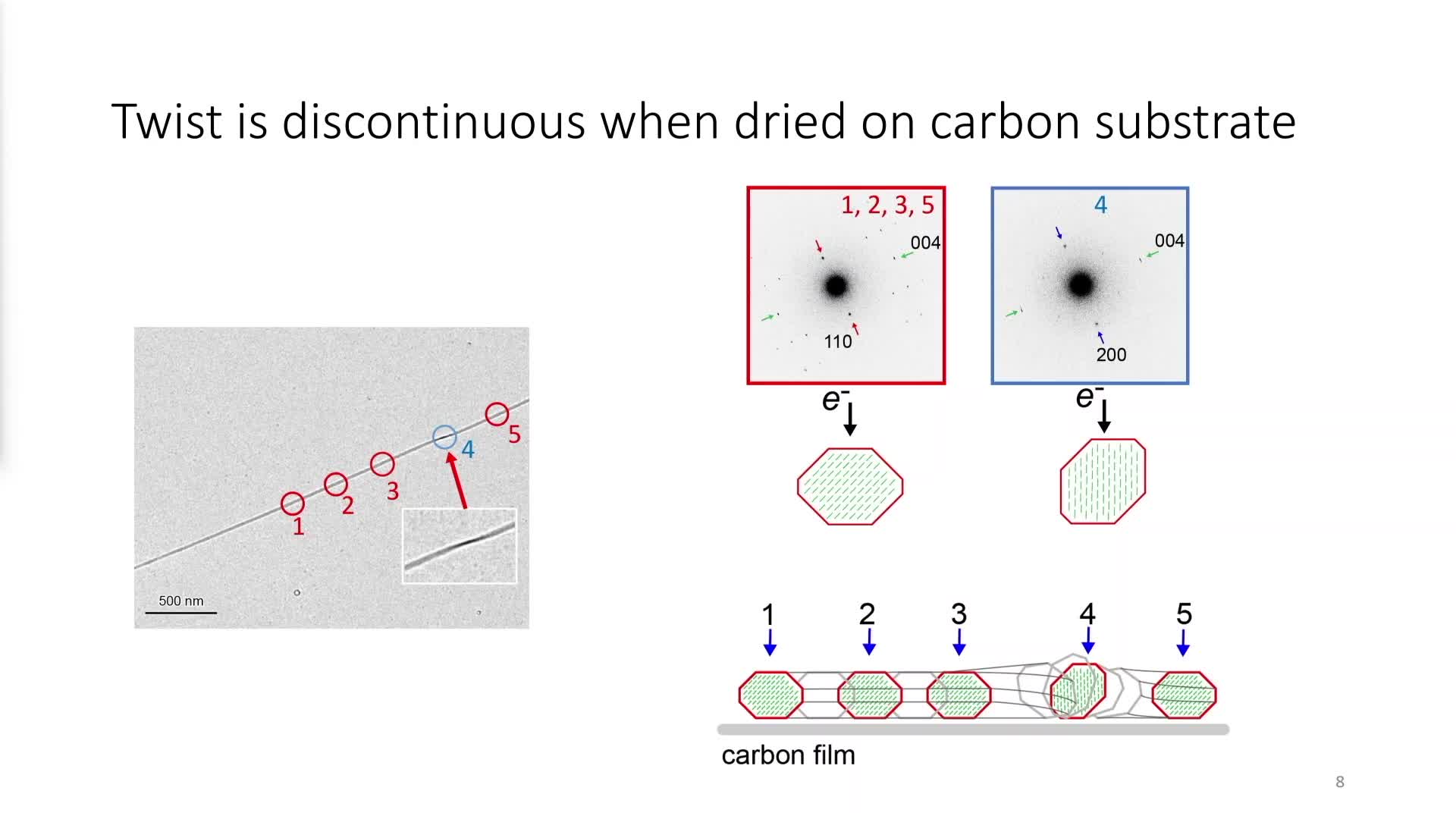
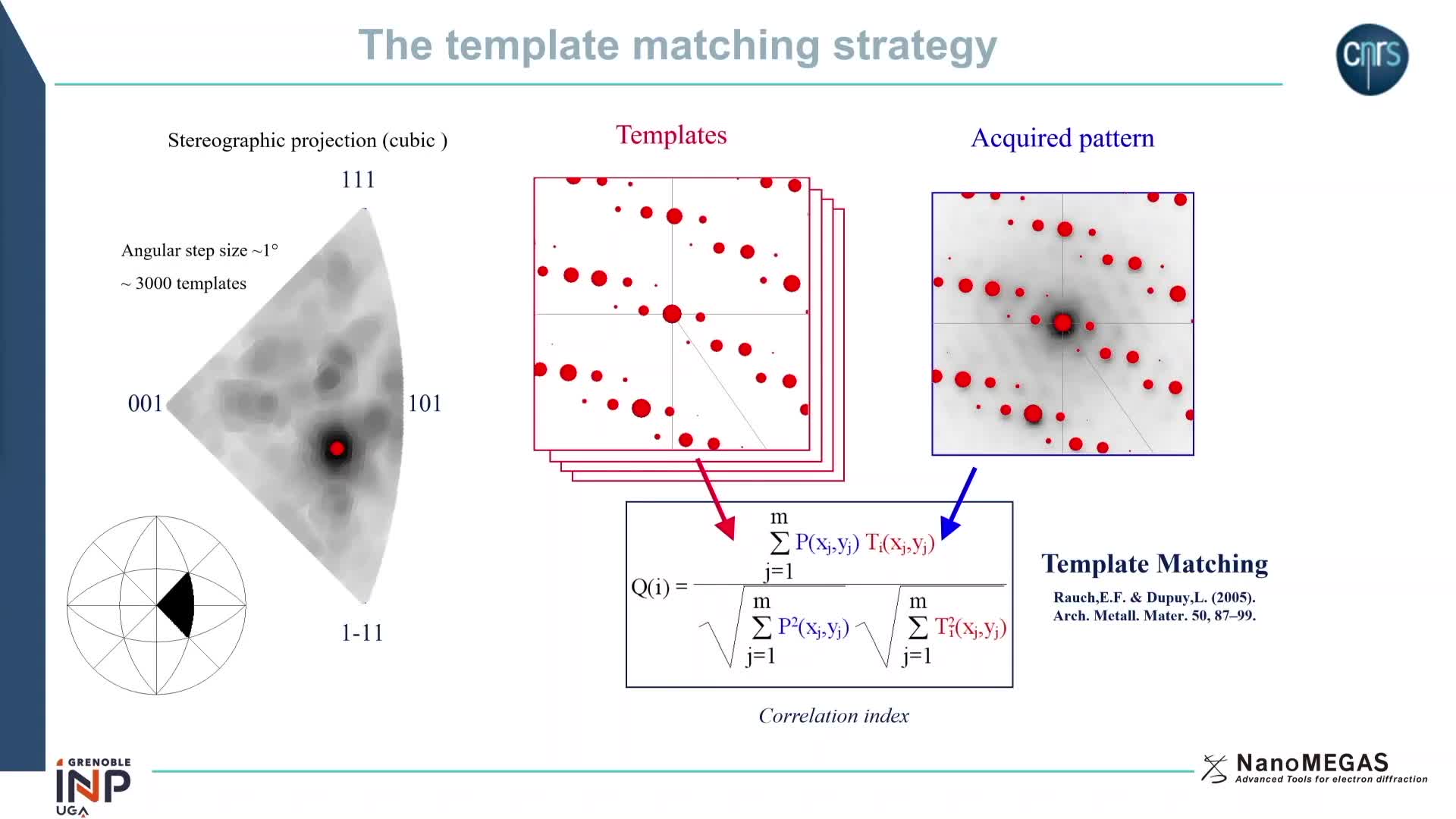
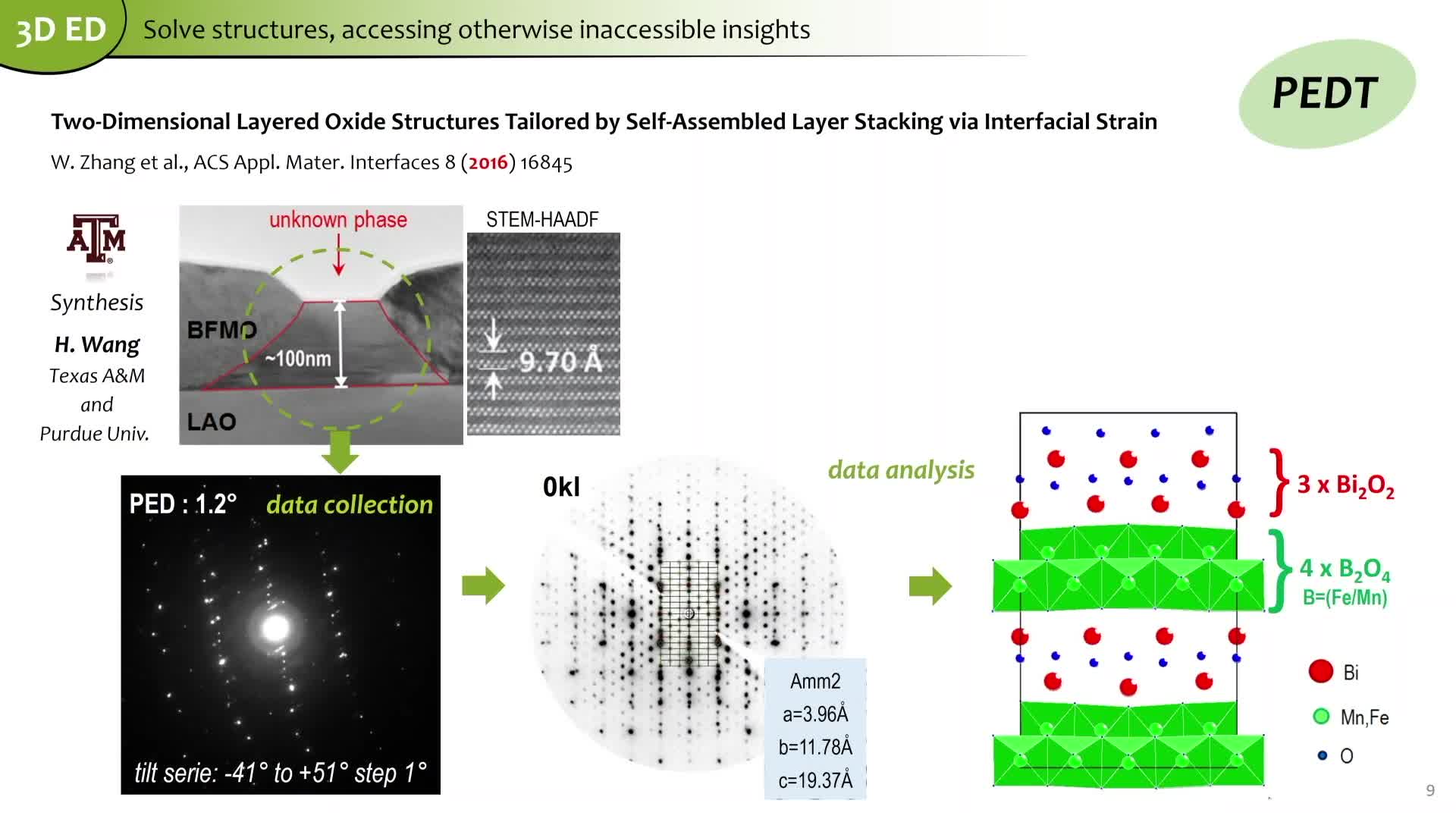
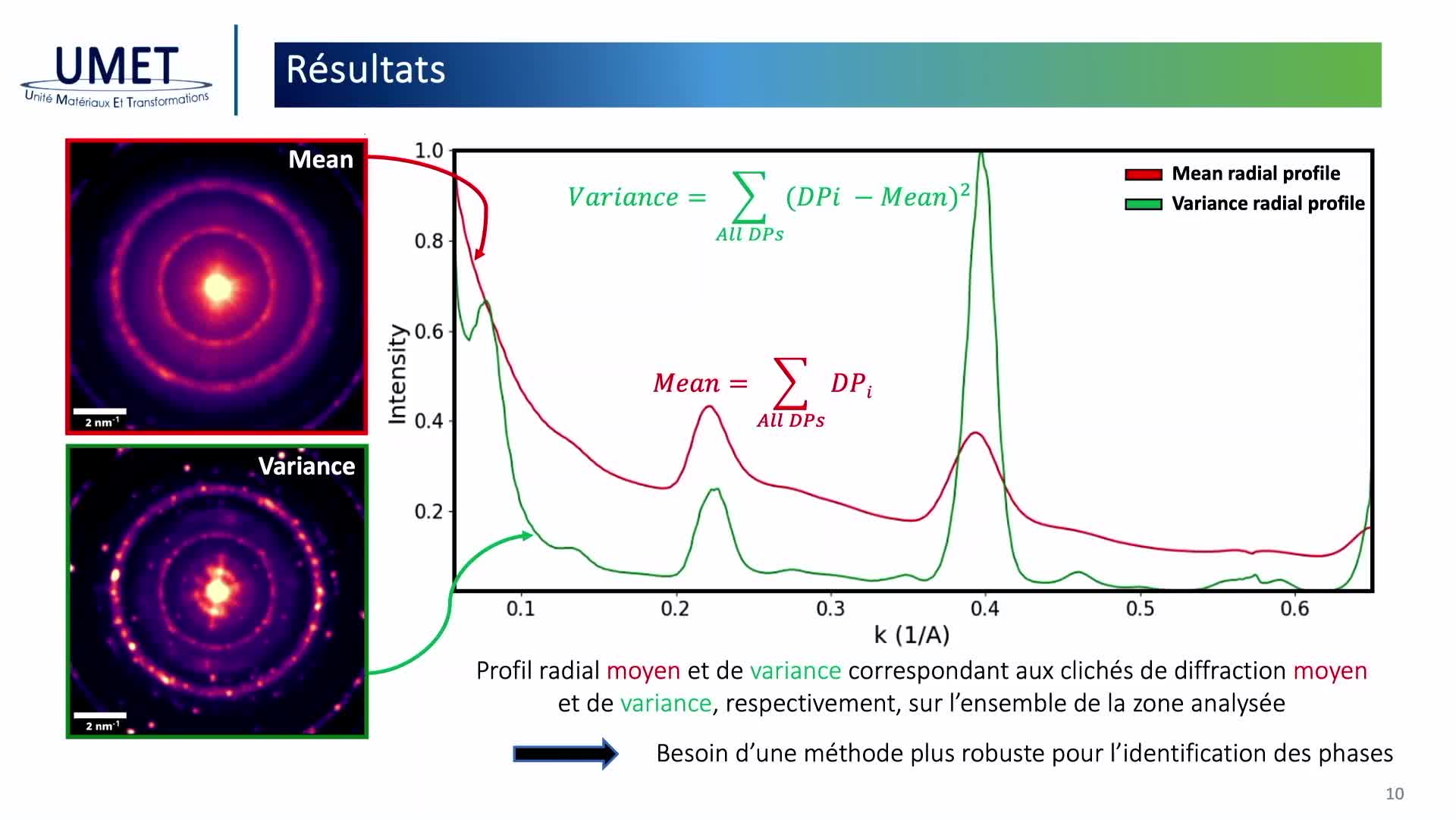
Chapitres
Notice
Voyage au centre des protéines
- document 1 document 2 document 3
- niveau 1 niveau 2 niveau 3
Descriptif
Les protéines sont les principaux acteurs du vivant, non seulement par leur quantité, mais surtout par la diversité des fonctions qu'elles exercent, allant de la catalyse de réactions chimiques jusqu'à la structuration de la matière vivante. Elles sont formées de longues chaînes d'acides aminés, qui se replient dans l'espace ; et cette structure tri-dimensionnelle est à la base de la fonction assurée par la protéine. Connaître la structure aux détails atomiques près, comprendre ses propriétés dynamiques, suivre les changements de conformation d'une protéine en action, intégrer ces connaissances aux données biochimiques et fonctionnelles constituent le coeur de la biologie structurale et permet d'avancer considérablement dans la compréhension de la fonction des protéines. Au cours de cet exposé, après avoir introduit quelques notions de base sur la composition des protéines, nous montrerons l'apport de la physique aux méthodes expérimentales permettant de sonder la structure des protéines et illustreront ensuite l'intérêt de ces études par quelques exemples.
Intervention / Responsable scientifique
Thème
Documentation
Documents pédagogiques
Texte de la 598 e conférence de l'Université de tous les savoirs prononcée le 20 juillet 2005
Par Eva Pébay-Péroula: « Voyage au centre des protéines »
Introduction 2
1. Importance des protéines dans la composition des cellules 2
La composition chimique des protéines 2
Le repliement des protéines 3
Intérêt des études structurales 4
2. Comment déterminer la structure d'une protéine 4
Principe de base de la cristallographie 4
L'utilisation du rayonnement synchrotron 6
La procédure expérimentale 6
Les approches complémentaires 7
3. Les protéines membranaires 7
La bactériorhodopsine 8
Le transporteur ADP/ATP 10
4. La biologie structurale de demain 13
Introduction
Les protéines sont les principaux acteurs du vivant, non seulement par leur quantité (environ 70 % en masse des molécules constituant une cellule), mais surtout par la diversité des fonctions qu'elles exercent, allant de la catalyse de réactions chimiques jusqu'à la structuration de la matière vivante, en passant par des rôles de moteurs moléculaires ou encore de communication entre cellules. Elles sont formées de longues chaînes d'acides aminés, qui se replient dans l'espace ; cette structure tri-dimensionnelle est à la base de la fonction assurée par la protéine. Connaître la structure aux détails atomiques près, comprendre ses propriétés dynamiques, suivre les changements de conformation d'une protéine en action, intégrer ces connaissances aux données biochimiques et fonctionnelles constituent le coeur de la biologie structurale et permet d'avancer considérablement dans la compréhension de la fonction des protéines. Au cours de cet exposé, après avoir introduit quelques notions de base sur la composition des protéines, nous aborderons les méthodes expérimentales permettant de sonder la structure des protéines et illustreront ensuite l'intérêt de ces études sur quelques exemples.
1. Importance des protéines dans la composition des cellules
La composition chimique des protéines
Les protéines sont des macromolécules faites par un enchaînement d'acides aminés (plusieurs centaines). Ces acides aminés sont choisis parmi 20, et diffèrent l'un de l'autre par un groupement chimique (chaîne latérale). Ces chaînes latérales ont des propriétés chimiques différentes, certaines sont chargées (positivement ou négativement) ou polaires, d'autres encore sont hydrophobes, certaines contiennent un cycle aromatique. Les séquences de protéines décrivent l'enchaînement des acides aminés et sont inscrites dans les chromosomes. Les suites d'acides nucléiques dans les gènes correspondent à une suite d'acides aminés, selon un code dans lequel trois acides nucléiques représentent un acide aminé. Pour décrire une protéine d'un point de vue chimique, il suffit de connaître la suite d'acides aminés. Si chaque acide aminé est représenté par une lettre, alors une protéine s'écrit de la façon suivante :
MGDHAWVDFSSRWSFLKDFLAGGVAAAVSKTAVAPIERVKLLLQVQHASKQISAEKQYKGIIDCVVRIPKEQGFLSFWRGNLANVIRYFPTQALNFAFKDKYKQLFLGGVDRHKQFWRYFAGNLASGGAAGATSLCFVYPLDFARTRLAADVGKGAAQREFHGLGDCIIKIFKSDGLRGLYQGFN
De façon plus explicite, la formule chimique plane d'un extrait de la séquence, par exemple celui correspondant à « WVDFSSR » s'écrit (les flèches indiquent la fin d'un acide aminé et le début du suivant):
Cette information est-elle suffisante pour connaître et comprendre la fonction d'une protéine ? La séquence en acides aminés, par comparaison à d'autres protéines, peut éventuellement donner des indications sur la fonction ou au moins une partie de la fonction. Mais ces informations sont insuffisantes et ne permettent pas de comprendre les mécanismes d'action dans lesquels la protéine est impliquée.
Le repliement des protéines
Les protéines in vivo se replient pour former une architecture tri-dimensionnelle. Leur fonction est corrélée à ce repliement. Les interactions mises en jeu sont toutes des interactions non-covalentes de faible énergie : liaisons Hydrogène, interactions électrostatiques, contacts de type van der Waals et effets hydrophobes. L'énergie impliquée dans ces types d'interaction est environ dix fois plus faible que l'énergie présente dans une liaison covalente. Ces interactions sont nombreuses, elles font aussi intervenir le solvant (les molécules d'eau, les ions présents dans le solvant). Actuellement, on ne sait pas prévoir par des calculs de dynamique moléculaire ou de minimisation d'énergie le repliement d'une protéine. En général, le calcul d'énergie montre un ensemble de minima proches, une petite imprécision sur un des paramètres de calcul peut entraîner des différences finales importantes. La structure d'une protéine correspond donc à une conformation stable mais modifiable en fonction de l'environnement puisqu'elle repose sur des interactions faibles. Cette propriété est à la base de nombreuses propriétés fonctionnelles. Les modifications de conformations peuvent résulter par exemple, d'un changement de pH, d'une interaction avec une petite molécule ou encore d'une interaction avec d'autres macromolécules (protéines, membranes, ADN,...). Les variations de conformations par rapport à la structure des protéines « au repos » sont donc importantes à connaître pour comprendre la fonction.
Intérêt des études structurales
Le but de la biologie structurale est donc de déterminer les structures de macromolécules (protéines, acides nucléiques, complexes protéines-protéines, protéines-acides nucléiques, protéines-lipides), de comprendre les propriétés dynamiques de ces assemblages, de suivre les changements de conformations en cours d'action et de mettre ces informations en lien avec les données fonctionnelles afin de comprendre les mécanismes moléculaires. L'intérêt de comprendre les mécanismes moléculaires est tout d'abord fondamental. Comprendre le bon fonctionnement d'une cellule eucaryote ou procaryote permet aussi de comprendre le dysfonctionnement, du par exemple à des protéines modifiées dans le cas de maladie génétique, à l'entrée et la propagation d'organismes pathogènes dans les cellules, ou encore à l'apparition de souches bactériennes résistantes aux antibiotiques. Connaître l'architecture précise des protéines cibles de médicaments permet de concevoir de façon rationnelle des nouvelles molécules, médicaments potentiels, ayant une spécificité très grande pour la cible et pouvant donc être utilisées à faible dose avec peu d'effets secondaires. La biologie structurale se situe donc à l'interface de la biologie, de la chimie et de la physique. Le problème à résoudre est biologique, les mécanismes réactionnels de catalyse enzymatique sont des processus chimiques. La physique contribue de façon importante aux méthodes expérimentales (cristallographie, diffusion du rayonnement, microscopie électronique,..), aux approches de modélisation (dynamique moléculaire), et aussi à la compréhension de certains processus (par exemple la contraction musculaire ou le fonctionnement de moteurs moléculaires).
2. Comment déterminer la structure d'une protéine
Dans la « Protein Data Bank » (PDB) sont présentes plus de 30 000 structures de protéines. Une majorité de ces structures ont été résolues par diffraction des rayons X, certaines par RMN, enfin un très petit nombre par diffraction des électrons. La méthode la plus courante est donc la cristallographie des rayons X.
Principe de base de la cristallographie
Le principe de base de la cristallographie repose sur l'interaction entre particule et rayonnement. En effet, un rayonnement envoyé sur une molécule va être diffusé par celle-ci et les caractéristiques de l'onde diffusée dépendent de la structure (et de la nature) des atomes rencontrés par l'onde incidente. Les principes physiques impliquent que d'une part, une interaction est nécessaire entre l'onde et la molécule et que d'autre part, la longueur d'onde de l'onde incidente doit être de l'ordre de grandeur des distances que l'on cherche à sonder. Par exemple, les rayons X ayant une longueur d'onde de l'Ångström sont intéressants car ce sont des ondes électromagnétiques qui interagissent avec les électrons (donc avec les atomes d'une molécule) et la longueur d'onde correspond aux distances interatomiques. La diffusion d'un tel rayonnement par une protéine contient toute l information sur les atomes de la protéine (nombre d'électrons donc nature des atomes et distances interatomiques donc structure de la protéine). Néanmoins, cette diffusion est tellement faible qu'elle ne peut être mesurée et pour l'augmenter il convient de prendre un grand nombre de molécules. Si ces molécules sont en solution, leur orientation relative sera aléatoire et la diffusion totale contiendra l'information d'une molécule mais moyennée suivant les orientations des molécules par rapport au faisceau incident. À l'autre extrême si on sait empiler de façon ordonnée un grand nombre de molécules, on forme alors un cristal à trois dimensions, le signal résultant est amplifié suivant des directions de diffusion privilégiées et nulle en dehors de ces directions (c'est le phénomène de diffraction ou d'amplification de Bragg).
En haut, exemples de cristaux. En bas, images de diffraction recueillies sur le détecteur.
Entre les deux situations extrêmes, molécules en solution ou molécules dans un cristal tri-dimensionnel, il existe des arrangements intermédiaires comme, par exemple, les fibres, arrangement à une dimension, utilisées pour résoudre la structure de l'ADN en 1953. La méthode la plus attractive est la cristallographie par rayons X utilisant des cristaux à trois dimensions, car si la qualité des cristaux est suffisante, on peut remonter à des structures avec une précision de positionnement des atomes meilleures que l'Å (10-10 m). Néanmoins, l'obtention de ces cristaux n'est pas toujours possible (les protéines peuvent être flexibles), et les autres approches sont alors complémentaires. En particulier, la diffusion des rayons par X par des protéines en solution a fait des progrès spectaculaires ces 4 dernières années grâce à l'amélioration des données expérimentales, et surtout aux développements des méthodes mathématiques permettant d'exploiter les données expérimentales.
L'utilisation du rayonnement synchrotron
Le rayonnement synchrotron est émis par des particules chargées relativistes lors d'une trajectoire courbe. Typiquement, on accélère des électrons à une vitesse proche de celle de la lumière et on les injecte dans un anneau, dit anneau de stockage, dans lequel on leur impose une trajectoire circulaire. Ils tournent alors dans l'anneau en émettant un rayonnement synchrotron tangentiellement à leur trajectoire. Ce rayonnement est constitué principalement de rayons X et a des caractéristiques exceptionnelles par rapport aux rayons X produits par les appareils conventionnels de laboratoire (similaires aux appareils utilisés pour les radiographies médicales). Parmi ces caractéristiques, on peut mentionner l'intensité du rayonnement, la possibilité de choisir la longueur d'onde (le rayonnement synchrotron est « blanc » et contient toute une fenêtre de longueur d'ondes) ainsi que la faible divergence du faisceau. De façon très résumée, on pourra travailler avec des cristaux beaucoup plus petits (de la taille de quelques microns) ayant des mailles très grandes (de l'ordre de 1000 Å ou 100 nm).
La procédure expérimentale
De façon résumée, les étapes clés sont les suivantes : préparation de la protéine à cristalliser (en quantité et en qualité suffisante), obtention des cristaux tri-dimensionnels, caractérisation du cristal et enregistrement de l'intensité et de la direction des ondes diffractées par le cristal, détermination des phases associées aux ondes diffractées (cette étape bien que parfois délicate, ne sera pas détaillée ici), calcul de la densité électronique du cristal (par transformée de Fourier à partir des intensités et des phases des ondes diffractées dans toutes les directions), construction d'un modèle moléculaire cohérent avec la densité électronique, affinement de ce modèle soit par minimisation d'énergie soit par des procédés de dynamique moléculaire (la minimisation est basée sur l'énergie de la molécule mais tient compte aussi de l'accord du modèle et des données expérimentales), et analyse de la structure en lien avec les données biochimiques et fonctionnelles connues par ailleurs afin de dégager les implications sur la fonction des protéines. Les mécanismes fonctionnels proposés pourront alors servir de base à d'autres expériences afin d'être validés. Par exemple, le rôle de certains acides aminés mis en évidence par cette analyse pourra être testé en les changeant et en étudiant les propriétés fonctionnelles de la protéine mutante.
Les approches complémentaires
La cristallographie n'est pas la seule méthode pour accéder aux structures, la RMN est une méthode alternative intéressante pour les protéines de plus petites tailles. Alors que la microscopie électronique permet d'approcher des architectures macromoléculaires de grandes tailles. Les approches multiples permettent aussi de répondre à différentes questions : architecture globale, détails atomiques, réarrangements structuraux, interactions avec des partenaires, mécanismes enzymatiques. La cristallographie par RX, la RMN, la diffusion de neutrons ou de RX, les calculs de dynamique moléculaire, la microscopie électronique, font partie de ces méthodes. Les protéines modulaires illustrent bien la nécessité d'utiliser des approches complémentaires. Ces protéines sont flexibles car elles sont faites de plusieurs modules ayant chacun une structure et une fonction bien définies. Ces modules sont reliés par des liaisons flexibles et se structurent dans l'espace. Les protéines modulaires ressemblent à des « lego » moléculaires qui sont très dynamiques et peuvent se restructurer en cours de réaction.
3. Les protéines membranaires
Parmi toutes les protéines, les protéines membranaires sont particulièrement intéressantes et peu de résultats sont encore connus. Comme leur nom l'indique, elles sont intégrées dans les membranes, membranes qui délimitent les cellules ou les compartiments cellulaires, et qui sont constituées principalement de lipides et de protéines. De façon simplifiée, on considère que les lipides assurent la compartimentation et l'étanchéité, alors que les protéines assurent les fonctions de communication (signalisation, transport et diffusion d'ions ou de petites molécules). L'intérêt des protéines membranaires sera illustré à travers deux exemples liés à la production d'énergie nécessaire à la cellule. L'étape principale en est la synthèse de l'ATP, adénosine triphosphate, petite molécule qui sert de carburant à la cellule car son hydrolyse en ADP libère de l'énergie. La synthèse de l'ATP nécessite un gradient de protons de part et d'autre d'une membrane. Le premier exemple concerne une protéine membranaire bactérienne responsable du gradient de protons, la bactériorhodopsine. Le deuxième exemple est celui d'un transporteur présent dans les mitochondries.
Molécule d'Adénosine Diphosphate (ADP)
La bactériorhodopsine
Vue schématique de la conversion de l'énergie lumineuse dans la bactérie H. salinarum en énergie chimique sous forme d'ATP
Certaines bactéries peuvent utiliser directement la lumière pour générer le gradient de protons. Ceci est fait grâce à une protéine membranaire, la bactériorhodopsine, qui après avoir absorbé la lumière visible expulse un proton. Le gradient électrostatique ainsi généré, est ensuite utilisé pour faire fonctionner l'ATP-synthase. La bactériorhodopsine est largement étudiée par la communauté scientifique depuis 25 ans car c'est un système modèle à de nombreux titres. En particulier, sa fonction est intéressante car on peut la considérer comme un système de photosynthèse simplifié, son étude permet de progresser dans la compréhension de la conversion d'énergie et du transfert de protons. De plus, cette protéine membranaire peut être obtenue en quantité suffisante et pure, elle est donc aussi intéressante pour développer des méthodologies de cristallisation.
Vue générale du squelette de la bactériorhodopsine
Les études structurales de la protéine au repos et juste après illumination montrent qu'il existe une molécule d'eau piégée au centre de la protéine et que l'absorption de la lumière déstabilise cette molécule d'eau ce qui entraîne un réarrangement structural permettant le passage d'un proton. Cette molécule d'eau est donc un élément clé, et seule une étude structurale fine peut accéder à ces informations. Ces études permettent de mettre en évidence des modifications structurales de l'ordre de l'Å se produisant dans la première moitié de l'action et sont ainsi très complémentaires aux travaux faits en microscopie électronique à plus basse résolution permettant de visualiser les grands mouvements présents dans la deuxième moitié de l'action.
La bactériorhodopsine appartient à une famille de protéines, les archaerhodopsines. Toutes sont présentes dans les membranes des archaebactéries halophiles et ont la capacité d'absorber un photon visible. Malgré une similitude en séquence d'acides aminés très importante, ces protéines utilisent l'énergie des photons pour assurer des fonctions très diverses : pompe à proton (bactériorhopsine), pompe à chlore (halorhodopsine) ou phototactisme (rhodopsines sensorielles). Comparer structure et fonction devient alors très intéressant et permet de mettre en évidence des différences structurales faibles en lien avec des différences de fonctions importantes.
Détail structural au centre de la protéine montrant un réseau de liaisons Hydrogène ainsi que des molécules d'eau dont une (W402) est essentielle pour le transfert de protons.
Le transporteur ADP/ATP
Dans les cellules eucaryotes, le processus est plus complexe et la synthèse de l'ATP se fait dans un compartiment spécialisé, la mitochondrie. La création d'un gradient de protons de part et d'autre de la membrane interne des mitochondries implique un ensemble de protéines membranaires (chaîne respiratoire). Le flux de retour des protons fournit l'énergie nécessaire à la régénération de l'ATP à partir d'ADP au niveau de l'ATP-synthase. À cause du caractère fondamental de ces processus, mais aussi par la possibilité de purifier ces protéines en quantité suffisante, de nombreuses études structurales ont été entreprises sur toutes les protéines de la chaîne respiratoire et ont permis d'obtenir les structures de la cytochrome C oxydase, de la fumarate réductase, du complexe bc1 et de la partie extramembranaire de l'ATP-synthase de plusieurs organismes.
Vue schématique de la chaîne de production d'ATP
Afin de satisfaire ses besoins énergétiques, la consommation d'ATP chez l'humain représente sa propre masse en 24h. L'échange entre l'ADP hydrolysé dans le cytosol et l'ATP régénéré dans les mitochondries est donc important et nécessite un système d'import-export mitochondrial très performant pour les nucléotides. Cet échange est assuré par une seule protéine membranaire : le transporteur de nucléotides présent dans les membranes internes des mitochondries, la membrane externe pouvant être traversée plus facilement (et moins spécifiquement) à l'aide de porines. Comprendre le mécanisme de transport nécessite de comprendre la reconnaissance sur un coté de la membrane de la petite molécule à transporter, et ensuite les changements de conformations permettant de la relâcher de l'autre coté. L'amplitude des changements de conformation a besoin d'être contrôlée, ce contrôle est en partie assuré par l'environnement des lipides de la membrane.
Le transporteur de nucléotides appartient à une famille de transporteurs mitochondriaux tous impliqués dans des processus métaboliques importants. Environ 60 transporteurs ont été identifiés chez l'humain. Le dysfonctionnement de ces transporteurs entraîne des maladies graves. Le transporteur ADP/ATP est le mieux caractérisé de tous à cause de son abondance naturelle et sert donc de modèle. Il a été caractérisé grâce à l'existence de deux inhibiteurs naturels : le carboxylatractyloside (CATR, poison naturel présent dans des chardons méditerranéens) et l'acide bongkrékique (BA). Ces inhibiteurs bloquent l'entrée de l'ADP dans les mitochondries et la sortie de l'ATP, respectivement. Ils sont donc supposés bloquer deux états conformationnels extrêmes du transport. La structure du transporteur en présence de CATR à 2.2 Å de résolution montre qu'il est constitué de six hélices transmembranaires inclinées formant une ouverture conique profonde du coté externe et fermé du coté de la matrice mitochondriale. L'analyse fine de la cavité permet de mettre en évidence des acides aminés importants dans la reconnaissance des nucléotides. Ces résultats donnent une première vue moléculaire du processus de transport et permettent d'émettre des hypothèses qui devront ensuite être validées par d'autres expériences.
Structure du transporteur ADP/ATP : le repliement en six hélices coudées et inclinées donne une forme ouverte vers l'espace intermembranaire de la mitochondrie (haut) et fermée vers l'intérieure de la mitochondrie (bas).
Coupe au travers du transporteur montrant la cavité par laquelle l'ADP peut entrer pour accéder à l'intérieur de la mitochondrie où il sera régénéré en ATP.
4. La biologie structurale de demain
Après avoir connu une période descriptive, les sciences du vivant ces dernières décennies ont abordé une phase plus quantitative qui a nécessité des nouveaux outils. La biologie structurale a émergé au cours de cette période et a surtout progressé dans les vingt dernières années du 20ème siècle grâce à la biologie moléculaire qui a permis la production de protéines recombinantes et à l'utilisation du rayonnement synchrotron. Elle a été initiée par des physiciens ou des chimistes reconvertis à la biologie. La biologie structurale est au départ une approche réductionniste dans laquelle une fonction biologique est disséquée au niveau moléculaire et la structure de chaque macromolécule ainsi identifiée est analysée et reliée à sa fonction. L'enjeu est maintenant d'aller plus loin et de remonter aux architectures supramoléculaires présentes dans le contexte cellulaire, et de comprendre les propriétés structurales et dynamiques liées à leur assemblage, afin de relier ces propriétés aux fonctions biologiques des assemblages. Cela implique de pouvoir aborder des structures de complexes de plus en plus larges et souvent transitoires dans le temps. En plus de la structure, les propriétés dynamiques permettant les réarrangements structuraux nécessaires aux fonctions devront aussi être comprises. Les échelles sont nanométriques (et sub-nanométriques), les temps caractéristiques peuvent varier de la picoseconde (10-12 s, par exemple l'absorption de lumière) à la milliseconde (comme certains réarrangement structuraux). Certaines approches existent déjà et demandent à être améliorées (cristallographie RX, diffusion de neutrons, microscopie électronique, RMN,...), d'autres approches sont à inventer. Le contexte favorable nécessite une interdisciplinarité réelle, des domaines disciplinaires forts (en biologie, en chimie et en physique) ainsi qu'un terrain propice aux développements technologiques.
Comprendre les relations structures-fonctions de toutes les protéines importantes dans un contexte cellulaire aura des répercussions dans les domaines pharmaceutiques et biotechnologiques, mais contribuera surtout à comprendre les mécanismes fondamentaux en biologie.
Liens
Partenaire de l'université de tous les savoirs 2001-2002 Accueil dans ses locaux les conférences
CERIMESPortail de ressources et d'informations sur les multimédias de l'enseignement supérieur
UTLS sur Lemonde.frLe monde
La conférence du 20/07/05 en audio (mp3)partenaire des UTLS
La conférence du 20/07/05 en audio (ogg)diffuse en audio les conférences en partenariat avec le CERIMES
La conférence du 20/07/05 en vidéo (real)Dans la même collection
-
La tribologie
BocquetLydéricLa tribologie est la science des frottements. Un 'frottement' intervient lorsque deux surfaces en contact sont mises en mouvement l'une par rapport à l'autre, produisant une force qui s'oppose au
-
La physique en champs magnétique intense
RikkenGeertLe champ magnétique semble toujours un peu mystérieux, pourtant les phénomènes magnétiques sont connus depuis presque trois mille ans et ont trouvé des applications partout dans notre vie quotidienne.
-
Le mécanisme de repliement des molécules
ChatenayDidierCe terme désigne le mécanisme par lequel une macromolécule linéaire (par macromolécule on entend un enchaînement linéaire de motifs moléculaires) acquiert une structure tridimensionnelle. Un tel
-
Quelles sources d'énergie d'ici à 2050 ?
DavidSylvainLa production d'énergie mondiale atteint 10 milliards de tonnes équivalent pétrole (tep) chaque année. Elle est assurée essentiellement par du pétrole, du gaz et du charbon, de façon très inégalitaire
-
L'eau : un liquide ordinaire ou extraordinaire
CabaneBernardL'eau est un liquide dont les propriétés sont tout à fait surprenantes, à la fois comme liquide pur et comme solvant. C'est un liquide très cohésif : ses températures de cristallisation et d
-
La physique des pâtes
CoussotPhilippeOn a l'habitude de classer la matière en solides, liquides ou gaz. Il existe cependant une classe de matériaux, les pâtes, dont le comportement mécanique et plus généralement les caractéristiques
-
Physique et sciences du globe
CampilloMichelLa Terre est une planète vivante dont l'intérieur garde de nombreux secrets. Comment voir sous la surface ? Les ondes sismiques sont les seules ondes qui se propagent jusqu'au centre de la Terre.
-
Le monde quantique au travail : l'optoélectronique
RosencherEmmanuelL'optoélectronique est une discipline scientifique et technologique qui a trait la réalisation et l'étude de composants mettant en jeu l'interaction entre la lumière et les électrons dans la matière.
-
La spintronique : des spins dans nos ordinateurs
FertAlbertLa spintronique : des spins dans nos ordinateurs par Albert Fert
-
La physique à l'échelle de la cellule
SykesCécileL'étude physique de phénomènes cellulaires a commencé à voir le jour il y a une quinzaine d'années grâce à l'essor considérable de la biologie cellulaire et grâce aux développements spectaculaires de
-
L'adhésion
LégerLilianeLes phénomènes d'adhésion sont présents partout dans notre quotidien, depuis l'expérience du bricoleur qui dépose un joint de colle pour réparer un objet (et chacun sait que si cela semble simple, ce
-
Les nanostructures semi-conductrices
GérardJean-MichelLorsqu'un matériau semi-conducteur est structuré à l'échelle du nanomètre ses propriétés électroniques et optiques sont gouvernées par la mécanique quantique. Le puits quantique, formé par une couche
Sur le même thème
-
-
An introduction to small angle x-ray scattering
Impéror-ClercMarianneAn introduction to small angle x-ray scattering
-
-
EELS, principe et application à l’étude des nanomatériaux inorganiques
NelayahJaysenEELS, principe et application à l’étude des nanomatériaux inorganiques
-
-
Nanoscale structural heterogeneity of crystalline carbohydrates
OgawaYuNanoscale structural heterogeneity of crystalline carbohydrates
-
-
-
Complémentarité diffraction électronique - diffraction des rayons X appliqués aux protéines
HoussetDominiqueComplémentarité diffraction électronique - diffraction des rayons X appliqués aux protéines
-
-
Analyse structurale par 4D-STEM d’échantillons astéroidaux
JacobDamienAnalyse structurale par 4D-STEM d’échantillons astéroidaux
-
Témoignages d’Anne et Pierre Joliot – Institut de biologie physico-chimique
DossoDianeJoliotAnneJoliotPierreDiane Dosso dresse un historique de l’IBPC.