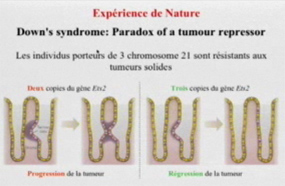
Chapitres
- Présentation01'39"
- introduction02'37"
- Historique05'54"
- La reconnaissance immunitaire09'22"
- Gènes et ADN09'01"
- Le complexe d'histocompatibilité10'50"
- Les partenaires des réactions immunitaires15'28"
- L'anaphylaxie08'45"
- Conclusion01'36"
- Questions21'19"
Notice
La diversité immunologique
- document 1 document 2 document 3
- niveau 1 niveau 2 niveau 3
Descriptif
La diversité du système immunitaire doit faire face à la diversité du monde extérieur, et plus précisément à celle des pathogènes : bactéries, virus, parasites. Suivant les espèces des stratégies cellulaires et moléculaires différentes ont été mises en place afin de répondre à ce défi. Comment se déroule cette course aux armements entre le système immunitaire et les agents infectieux et où s'arrête la capacité du système immunitaire face à un ennemi aussi multiple et varié. Derrière ce questionnement se profile l'éternel espoir de prolonger la vie. L'homme peut-il supplanter l'évolution dont le projet essentiel est la reproduction. Cette question éthique risque d'être abordée très différemment par les humains suivant leur foi et leur culture.
Intervention / Responsable scientifique
Thème
Documentation
Documents pédagogiques
Texte de la 429e conférence de l'Université de tous les savoirs donnée le 8 juillet 2002
Jean-Claude Weill,« La diversité immunologique »
Notre système immunitaire possède plusieurs qualités qui lui confèrent son efficacité. Tout d'abord, il est spécifique, et peut donc nous protéger contre une infection précise. Il peut aussi s'améliorer dans le temps, ce qui est une des propriétés de la vaccination : quand il a rencontré un agent pathogène une première fois, l'organisme sait mieux se défendre les fois suivantes. De plus, il est doté d'une mémoire : après vaccination, les lymphocytes qui nous protègent le mieux vont être conservés dans l'organisme pendant vingt ou trente ans et cela sans que l'on sache encore comment. Enfin, à l'aide d'un système de filtrage, il distingue le soi et le non soi ce qui évite que le système immunitaire ne s'attaque à l'organisme et induise des pathologies très graves dites auto-immunes.
La compréhension des mécanismes de fonctionnement du système immunitaire passe tout d'abord par l'étude de ses différents acteurs cellulaires et moléculaires, et notamment les anticorps, les lymphocytes B, et T, les molécules du CMH et les macrophages.
L'histoire de l'immunologie commence en 430 av. J.-C. Thucydide, qui relate un épisode de peste à Athènes, écrit avec beaucoup d'intuition : « On se montrait plus compatissant avec les malades, une fois que l'on avait soi même réussi à surmonter l'épreuve, car tout en sachant par expérience ce qu'il en était, on se sentait à l'abri du danger. En effet le mal ne frappait pas deux fois un même homme ou du moins la rechute n'était pas mortelle. » Il décrit ainsi le principe de la vaccination : une fois que l'on a été infecté par l'agent pathogène, si l'on n'en meurt pas, on est protégé d'une nouvelle rencontre avec celui-ci. Il faudra attendre 2 000 ans pour que Edward Jenner, en 1796, un médecin anglais applique cette leçon de la peste au cas de la variole, dont les gens meurent à cette époque. Partant de l'observation que les bovins peuvent eux aussi attraper la variole, il prend un peu de germe de la variole bovine non infectieuse pour l'homme qu'il inocule à des patients, les protégeant ainsi de la variole humaine. L'acceptation de cette découverte par les médecins, à travers le monde, prendra encore 50 à 60 ans. Un siècle après, Louis Pasteur montre qu'il n'est pas nécessaire de prendre l'agent pathogène d'une autre souche, mais qu'il suffit de chauffer l'agent qui infecte l'humain, ce qui le rend moins virulent, donc incapable de provoquer la maladie mais apte à provoquer la vaccination. La question se pose alors, à cette époque, de savoir ce qui protège les individus contre les maladies : s'agit-il de cellules ou de molécules contenues dans le sang. Cette controverse oppose Louis Pasteur et Robert Koch.
Emil von Behring montre en 1890 que l'immunité peut être transmise par un sérum du sang ne contenant pas de cellules. Il appelle les molécules responsables de l'immunité des anticorps. En 1920, Karl Landsteiner, qui a découvert les groupes sanguins, montre que l'on peut obtenir des anticorps contre n'importe quelle substance. Le système immunitaire peut donc réagir contre tout ce qui lui est présenté. Cela pose le problème de savoir comment fait le système immunitaire pour ne pas reconnaître le soi.
L'ensemble de ces découvertes aboutit à l'oubli total de la théorie cellulaire, et ceci pendant 50 ans à partir de 1900, sans que soit pour autant résolue la question de savoir comment sont produits les anticorps. A partir de la deuxième moitié du 20ème siècle, on redécouvre que le sang contient une multitude de cellules, et l'on s'aperçoit qu'elles dérivent d'un type de cellules particulières, les cellules souches hématopoïétiques. Ces dernières donnent naissance à différents types de lignées : la lignée lymphoïde (qui produira les lymphocytes), la lignée myéloïde (qui produira les lignées phagocytaires, c'est à dire les macrophages, les monocytes, les granulocytes basophiles, neutrophiles, et éosinophiles), la lignée erythroide qui produit les globules rouges. Les anticorps sont produits par des lymphocytes particuliers, de type B. Les lymphocytes de type T produisent, eux, un autre type de molécules de reconnaissance.
Comme souvent dans les polémiques scientifiques les deux théories contribuent à la réalité : des cellules et des molécules sont responsables de l'immunité.
Pour bien comprendre le mode d'action des anticorps, il faut raisonner en terme de reconnaissance. Il faut s'imaginer l'anticorps comme une pince (par exemple anti a) qui s'adapterait parfaitement à l'objet a, qui le reconnaîtrait : la pince anti a est spécifique de l'objet a. En revanche, cette pince anti a reconnaîtrait moins bien un objet b. Tout le système immunitaire va être basé sur ce principe. L'amélioration du système immunitaire, grâce à la vaccination, provient ainsi de l'amélioration de la reconnaissance d'une pince anti x spécifique du bacille du tétanos par exemple, ce qui permettra à cette pince de se débarrasser plus facilement de l'agent pathogène, lors d'une nouvelle rencontre. L'amélioration de cette pince va se faire dans les organes lymphoïdes, rate et ganglions, en une à deux semaines, par hypermutation spécifique des gènes codant cet anticorps (voir plus bas), et c'est cette cellule lymphoïde fabriquant cette pince améliorée qui va rester dans l'organisme dix ou vingt ans. Mémoire et amélioration de la réponse sont donc intimement liées.
Il faut donc un lymphocyte B pour fabriquer un anticorps donné (une pince). Le lymphocyte B porte à sa surface un anticorps que l'on appelle un récepteur et c'est cet anticorps qu'il fabrique. Cette cellule x peut ainsi attraper l'élément X. Il en va de même pour une cellule y avec un élément Y. Le système immunitaire produit ainsi des millions de cellules qui peuvent reconnaître des millions de corps différents. Ainsi, chaque fois qu'un virus, une bactérie ou une cellule greffée est introduite dans l'organisme, il existe un lymphocyte B possédant un récepteur spécifique pour chacun de ces éléments.
C'est dans la moelle osseuse que sont produites, chaque jour, ces cellules, et aucune des cellules produites ne va pouvoir s'attaquer à l'organisme, donc porter de récepteur qui reconnaît le soi. Cela est dû au fait qu'au cours de cette production, dans la moelle osseuse, une cellule qui reconnaît le soi va être éliminée. C'est ce que l'on appelle la sélection négative, qui permet au système immunitaire de reconnaître tout l'extérieur sans attaquer l'intérieur.
Cinq milliards de lymphocytes B sont produits chaque jour dont 95 % vont mourir dans les 48 heures. Il y en a 400 milliards dans le corps, et nous portons en tout approximativement 10 millions de spécificités différentes d'anticorps.
La question de la génération de la diversité (Generation Of Diversity) a interpellé les immunologistes dans les années 70. Il est maintenant connu que le génome ne contient pas plus de 30 000 gènes. Il est donc exclu que chaque anticorps soit codé par un gène différent. Linus Pauling a suggéré que le nombre d'anticorps différents soit en réalité assez restreint, mais que la pince soit assez plastique pour s'adapter à chaque molécule différente qu'elle rencontre. Cette théorie de l'induction s'est cependant avérée fausse.
La compréhension de ce phénomène de GOD s'effectuera grâce à la biologie moléculaire.
En 1954, à Cambridge, Jim Watson et Francis Crick font une des plus belles découvertes du siècle en biologie, et démontrent que le support de l'hérédité est l'ADN, une molécule organisée en une double hélice, qu'utilisent toutes les espèces vivantes. Les longs brins d'ADN sont présents dans chacune de nos cellules, sous la forme repliée et compactée de nos 23 paires de chromosomes. S'ils étaient débobinés et mis bout à bout, ils atteindraient une longueur de 1m40 par cellule. Les brins d'ADN sont composés de la succession de quatre lettres : A, T, G, C que l'on appelle des bases. Le génome humain en compte deux milliards. L'assemblage linéaire de ces bases n'est pas neutre : il s'organise en unités de transcription, des gènes, qui ont un début et une fin, qui codent pour des protéines. Il y a environ 30 000 gènes. Chaque cellule possède le patrimoine génétique complet mais n'exprime qu'un certain nombre de gènes, qui sont différents selon que la cellule est une cellule de rétine ou de peau par exemple. Les autres sont silencieux. Si le gène est exprimé, l'ADN est transcrit en ARN dans le noyau, puis est traduit, dans le cytoplasme, en une protéine, composée d'acides aminés, l'anticorps par exemple, le lymphocyte B 1 exprime l'anticorps 1.
Pour expliquer toutes les spécificités d'anticorps existantes, Susumu Tonegawa démontre qu'il n'existe pas dix millions de gènes, mais que c'est une combinaison qui permet d'aboutir à ce chiffre. Il propose quatre groupes (V, D, J et C) comportant en totalité une centaine d'éléments. Chaque lymphocyte, produit dans la moelle osseuse, va prendre un élément de chaque groupe de manière aléatoire, et ainsi présenter une combinaison unique (par exemple V69D5J4C2) qui va coder pour un récepteur unique. En outre, le réarrangement, la recombinaison entre chacun des segments, se fait de manière imprécise, ce qui aboutit à une diversité supplémentaire. Au moment de l'émigration de la moelle osseuse, il est vérifié pour chaque cellule que la combinaison n'aboutit pas à la production d'un récepteur reconnaissant le soi.
Au moment où l'agent pathogène entre dans l'organisme, il rencontre le lymphocyte B qui a le récepteur spécifique complémentaire de l'antigène à sa surface. Le lymphocyte B va alors sécréter des milliers d'anticorps, identiques au récepteur présent à sa surface, qui vont se lier à l'agent pathogène et l'éliminer. La réponse immédiate du système immunitaire est donc de faire des milliers d'anticorps contre un agent pathogène afin de se fixer à lui et s'en débarrasser.
Quand une bactérie ou un virus sont présents à l'état complet dans le corps, ce sont les lymphocytes B qui vont reconnaître cet agent pathogène par l'intermédiaire de leur anticorps de surface qui va par la suite être sécrété en grande quantité.
Il existe aussi des infections cellulaires, qui sont très rapides, au cours desquelles un virus entre dans l'organisme et va immédiatement se loger à l'intérieur d'une cellule, où il s'intègre dans le génome. Il se sert de la machinerie de la cellule pour subsister : quand les chromosomes se divisent et se répliquent, le virus, qui y est intégré, se réplique aussi, transformant ainsi la cellule en usine à virus. Si ces agents n'ont pas été attaqués lorsqu'ils étaient dans la circulation, le système immunitaire B ne peut plus les reconnaître maintenant qu'ils sont intracellulaires. C'est notre système immunitaire T qui va être capable de s'attaquer aux cellules infectées pour les tuer, et ceci en préservant les cellules saines.
En 1974, Peter Doherty et Rolf Zinkernagel sont à l'origine du concept du soi modifié, qui introduit deux nouveaux acteurs de la réponse immunitaire : le lymphocyte T et le CMH (le Complexe Majeur d'Histocompatibilité, HLA chez l'homme pour Human Leucocyte Antigen), qui représente la carte d'identité biologique d'un individu. Le complexe HLA est formé de trois gènes, A, B et C, présentant chacun 99 types (on parle d'haplotypes). Un individu est par exemple A28B96C3. Ces trois protéines, qui représentent l'équivalent du numéro de sécurité sociale d'un individu, sont présentes à la surface de toutes les cellules de son organisme. Leur rôle premier est de présenter, comme dans une vitrine, un échantillon des protéines présentes dans la cellule, sous forme de fragments peptidiques, que la cellule produit constamment. La plupart du temps, il s'agit de protéines du soi. Si la cellule est infectée par un virus, elle présente aussi des morceaux de virus. C'est cela que reconnaît le lymphocyte T : le soi modifié, le peptide viral présenté dans le contexte du HLA. Le lymphocyte T, qui se différencie dans le thymus, présente lui aussi une pince à sa surface qui reconnaît le HLA, le récepteur T, mais ce dernier n'est jamais sécrété. La cellule T scrute constamment le HLA des cellules qu'elle rencontre. Si elle rencontre une cellule infectée, son récepteur T reconnaît le soi modifié, et le lymphocyte T la tue ; si la cellule rencontrée est saine, il y juste reconnaissance du soi et rien ne se passe. Comme pour le lymphocyte B et l'anticorps présent à sa surface, chaque lymphocyte T porte un récepteur T spécifique à sa surface, soumis aux mêmes règles quant à la génération de la diversité, des groupes de plusieurs centaines de gènes se recombinant de manière aléatoire pour le générer.
En revanche, la sélection des cellules T se fait de manière un peu différente. Alors que la cellule B n'est éliminée que si elle reconnaît, avec une forte affinité, une molécule du soi pendant le développement, la cellule T passe par une étape de sélection supplémentaire. En effet, le lymphocyte T doit reconnaître du soi modifié, c'est à dire un peptide, mais dans le contexte du HLA, alors que le lymphocyte B reconnaît un corps étranger à l'état isolé. Dans le thymus, la cellule T est éliminée si elle reconnaît du HLA qui présente du soi de façon forte : c'est la sélection négative, mais, à la différence de la cellule B, il faut aussi qu'elle reconnaisse un peptide du soi, associé au HLA de façon faible, pour se maintenir dans l'organisme : c'est la sélection positive.
Le dernier partenaire de la réponse immunitaire est le macrophage, une cellule phagocytaire qui lorsqu'elle rencontre une bactérie ou un virus l'intercepte, l'ingère et le dégrade. Le travail d'Elie Metchnikov, en 1900, a beaucoup apporté à la connaissance des macrophages. Il a mis le doigt sur un des acteurs centraux de la réponse immunitaire en remarquant qu'il existait chez l'étoile des mers des cellules capables de se présenter immédiatement au point d'entrée d'un corps étranger, pour l'ingurgiter et le phagocyter. Les rôles du macrophage sont multiples. Non seulement, il phagocyte des micro-organismes infectieux, mais il alerte le système immunitaire, grâce à la sécrétion d'interleukines qui sont des messagers moléculaires, et grâce à la présentation aux lymphocytes des molécules du pathogène.
Lorsqu'un agent pathogène (comme le bacille du tétanos par exemple) pénètre dans l'organisme, il provoque une réponse immédiate (primaire). La première ligne de défense, le macrophage (la réponse innée) reconnaît le virus ou la bactérie, le phagocyte, le fragmente pour le présenter à sa surface avec le HLA et ainsi activer la cellule T, qui est alors en mesure de tuer les cellules infectées qu'elle rencontre en patrouillant dans l'organisme. Dans le même temps, le lymphocyte B approprié reconnaît le bacille du tétanos entier et sécrète les anticorps. Tout est question de rapidité : si l'infection est plus rapide que le système immunitaire, si l'agent pathogène n'est pas tué immédiatement, il peut se propager très vite et provoquer la mort de l'organisme.
Cette réponse primaire a lieu en quelques jours. Si l'infection est endiguée, il faut en garder la mémoire, pendant parfois plus de vingt ans. L'organisation de la mémoire passe par une cellule particulière, le lymphocyte T CD4, à laquelle les macrophages ont aussi présentés l'antigène. Cela va permettre de produire deux types de cellules CD4, l'une chargée d'induire la génération des cellules B à mémoire et la maturation de l'affinité des anticorps, et l'autre d'induire la maturation de la réponse des lymphoctes T. Cette cellule est donc au cSur de la stratégie de défense immunitaire de l'organisme. C'est elle que va reconnaître et détruire le virus du SIDA. C'est pour cette raison que le taux de cellules T CD4 positives dans l'organisme représente un marqueur important de l'évolution de la maladie.
Au niveau spatial, le sang contient donc toutes les cellules concernées par la réponse immune. Lorsqu'un agent infectieux traverse la barrière de la peau suite à une coupure par exemple, les macrophages qui sont présents sur les lieux, le reconnaissent, le phagocytent, et enclenchent une réaction inflammatoire, en sécrétant des cytokines et en recrutant d'autres acteurs, des éosinophiles, rendant les vaisseaux voisins plus perméables, ce qui permet aux cellules présentes dans le sang de rentrer dans le périmètre infecté. Le macrophage chargé d'agents infectieux atteint les organes lymphoïdes, comme la rate et les ganglions, par la circulation lymphatique, et c'est là qu'il active les lymphocytes T et B naïfs spécifiques de l'agent pathogène. Les lymphocytes une fois activés vont revenir sur les lieux de l'infection pour maîtriser celle-ci.
Le système immunitaire ne fonctionne cependant pas toujours aussi bien qu'il le devrait et peut être néfaste pour l'organisme au lieu de le protéger. Charles Richet en a ainsi fait l'expérience en 1902, lorsqu'il a découvert le phénomène d'allergie. Il a piqué son chien une première fois avec une anémone de mer, ce qui n'a pas eu d'effet. Mais, lorsqu'il a recommencé l'opération, le chien en est mort. Au lieu d'avoir provoqué une réaction de vaccination, la piqûre avait provoqué une réaction allergique. Le système immunitaire quand il est déréglé peut ainsi être redoutable, et anéantir un organe, voire un individu. Une maladie auto-immune peut ainsi être déclenchée si l'infection va plus vite que le système immunitaire. La cellule T, activée par un macrophage qui a reconnu l'agent infectieux, tue toutes les cellules infectées, mais, dans le cas, par exemple, où le virus a été plus rapide et a réussi à infecter un organe, ces cellules T vont pouvoir attaquer celui-ci et le détruire. Il peut aussi arriver qu'un antigène bactérien soit identique à un antigène du soi, ce qui peut induire une réaction d'auto-immunité par mimétisme moléculaire : le système immunitaire attaque le soi car il croit combattre l'étranger. Il existe aussi des parties du corps que le système immunitaire ne voit jamais, et donc des antigènes auxquels les lymphocytes n'ont jamais été confrontés (les antigènes séquestrés). Si, à la suite d'un traumatisme ou d'une infection, le système immunitaire entre en contact avec ces antigènes qu'il n'a jamais vu (de l'Sil par ex.) il peut penser qu'il a à faire à du non soi.
En conclusion, il reste de grandes questions à résoudre pour comprendre le fonctionnement du système immunitaire et, notamment, celle de l'amélioration de la réponse. Ce phénomène est connu depuis 50 ans et on commence seulement à comprendre son mécanisme moléculaire. Nous venons de montrer, avec Claude-Agnès Reynaud, que des polymérases spécifiques, dites « error prone », chargées de franchir des lésions lors de la réplication semi-conservative mais, faisant des fautes lorsqu'elles copient l'ADN normal, seraient responsables du processus d'hypermutation permettant cette amélioration.
Par ailleurs, comment expliquer le phénomène, assez étonnant, de la mémoire immunitaire qui permet à une cellule de rester des décennies dans l'organisme, tout en gardant la mémoire de sa première rencontre avec l'antigène ?
Liens
La Web TV de l'enseignement superieur
Université René Descartes Paris-5Partenaire de l'université de tous les savoirs 2001-2002 Accueil dans ses locaux les conférences
CERIMESPortail de ressources et d'informations sur les multimédias de l'enseignement supérieur
Le texte de la conférence du 08/07/02 en pdfDans la même collection
-
Conflit, ritualisation, droit : la gestion de la diversité
MichaudYvesPsychologiquement, la relation humaine à la diversité est ambivalente : la diversité suscite la curiosité et stimule ; en même temps elle apparaît comme une menace et déclenche l'agressivité. Les
-
Les universaux de pensée
ChangeuxJean-PierreLa pensée est liée au cerveau, une entité matérielle qui possède une organisation complexe. Les universaux de pensée se développent à partir de cette organisation. Elle se construit au court de l
-
La diversité biologique comme objet social et objet légal
VivienFranck-DominiqueLes années 80 ont été le témoin de la reconnaissance de la diminution de la diversité biologique en tant que problème global d'environnement. Il s'agit là d'une problématique appartenant à la classe
-
Invariants anthropologiques et diversité culturelle
DescolaPhilippe"Si les réactions d'alarme que suscitent les transformations de l'environnement et le développement des biotechnologies expriment souvent une évaluation sérieuse des risques encourus, elles prennent
-
Être et ne pas être un animal
ProchiantzAlainIl n'y a que des individus dans la nature. Mais qu'est-ce qu'un individu ? Le sens de ce terme est-il le même pour tous : bactéries, plantes, oiseaux, souris, êtres humains ? La réponse, selon le
-
-
Génétique, populations et maladies
Cambon-ThomsenAnneGènes, Populations et Maladies : pour aborder ce thème, c'est la vision de la Génétique des populations humaines que j'ai choisie et qui va, à travers quelques exemples de projets de recherche, nous
-
Hommes et hominidés
SenutBrigitteIl s'agit d'explorer la dichotomie entre les grands singes et l'Homme et comment comprendre cette divergence aujourd'hui. En consultant les médias, on voit souvent évoquer le fait que l'Homme partage
-
Diversité et identités humaines : du côté de l'immunologie
MoulinAnne-MarieLa diversité du monde vivant a toujours été un objet d'émerveillement. De la part des théologiens, qui trouvaient dans le catalogue de la vie une occasion de s'extasier sur l'oeuvre de la Providence.
-
Domestication animale et diversité
VigneJean-DenisEngagée il y a plus de 10 000 ans au Proche Orient, la domestication animale compte parmi les événements majeurs de l'histoire de l'humanité. Elle s'est accompagnée de profonds bouleversements
-
Végétaux : diversité, hybridation
MugnierJacquesEn 1998, le Groupe sur la Phylogénie des Angiospermes (APG) publie une étude phylogénétique des plantes à fleurs en comparant des séquences de l'ADN chloroplastique. Ces taxonomistes moléculaires ne
-
La vie dans des conditions extrêmes
López-GarcíaPurificaciónAu cours des 30 dernières années, nous avons assisté à la découverte d'une extraordinaire diversité de microorganismes habitant des milieux que l'on croyait auparavant hostiles à la vie. Aujourd'hui,
Avec les mêmes intervenants et intervenantes
-
L'homme transgénique : des possibilités infinies - M. Radman, JC Weill
RadmanMiroslavWeillJean-ClaudeUne conférence du cycle : Qu'est ce que la vie ? Où en est la connaissance du génome ? Miroslav Radman, Généticien, Université Paris 5, faculté de médecine Necker Et Jean-Claude Weill,
Sur le même thème
-
Intra-Domain Cysteines (IDC), a New Strategy for the Development of Original Antibody Fragment-Drug…
JolivetLouis35ème Colloque BioTechnoCentre 19-20 octobre 2023, la Ferme de Courcimont ((Nouan le Fuzelier, 41600 F)
-
LabEx MAbImprove : douze premières années d’existence qui ont déjà profondément marqué la Touraine …
WatierHervé35ème Colloque BioTechnoCentre 19-20 octobre 2023, la Ferme de Courcimont (Nouan le Fuzelier, 41600 F)
-
Comment mesurer les accélérations et décélérations des phénomènes en incertitude ?
Leclerc-OliveMichèleTeschlMiriamGuiotJoëlSchwarzingerMichaëlQui aurait pu penser que nous aurions à vivre avec un nouveau virus ? Comment le changement climatique va-t-il modifier notre vie ? Qu'en est-il des événements que nous n'envisageons même pas ?
-
Covid : la pandémie est-elle terminée ? L’avis du virologue Patrick Mavingui
MavinguiPatrickPèdreCédricLes Causeries de la santé : Spéciale Covid #7 - Bientôt la fin du covid ?
-
SANTE LIVE #5 - Le diabète
Émission présenté par Cédric PEDRE (Directeur de l'IREPS Réunion) Au programme de cette troisième émission Santé live -Les facteurs de risque -Le dépistage -La prévention Intervenants :
-
SANTE LIVE #4 - Les vaccins
Présenté par Cédric Pedre directeur de l'IREPS Plus que jamais la vaccination est le sujet numéro un de santé publique. C'est pourquoi il est important d'en parler avec des spécialistes. Au
-
SANTE LIVE #1 - Du prédiabète au diabète
Bienvenue dans notre première émission consacrée au diabète, présenté par Cédric Pedre, directeur de l'IREPS Réunion. Le diabète est une maladie qui touche une grande partie de la population
-
SANTE LIVE #2 - La contraception
Cédric Pedre et le Professeur Von Theobald vous parle dans cette émission de contraception. Vous aurez dans cette émission des informations médicales sur les moyens de contraception, des surprises et
-
SANTE LIVE #3 - Maladies et tests génétiques
Émission par Cédric PEDRE (Directeur de l'IREPS Réunion) et Pr Bérénice DORAY, PU-PH Génétique, Vice-doyenne Recherche UFR Santé de l'Université de La Réunion, directrice du service Génétique du CHU.
-
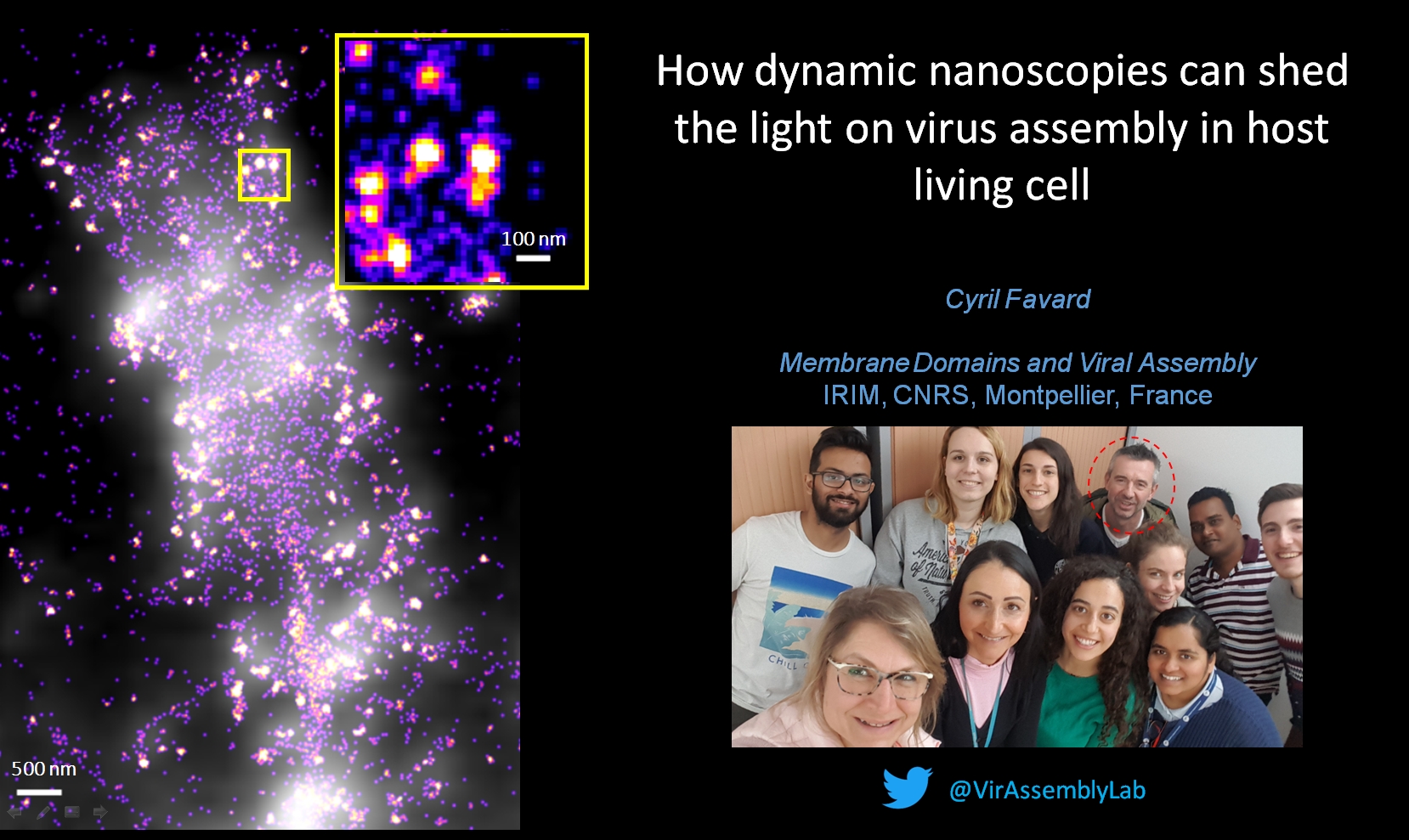
How dynamic nanoscopies can shed the light on virus assembly in host living cell
FavardCyrilPrésentation Cyril Favard Institut de Recherche en Infectiologie de Montpellier - IRIM - CNRS Montpellier
-
-